Электролиты и неэлектролиты. Электролическая диссоциация неорганических кислот, солей, щелочей. Степень диссоциации.
Электролиты и неэлектролиты
Электрический ток — направленное движение заряженных частиц под действием внешнего электромагнитного поля.
Заряженные частицы:
электроны — ток в металлах;
ионы — ток в растворах.
Электролиты — вещества, растворы которых проводят электрический ток: растворимые кислоты, щелочи, соли. Связь ионная или сильнополярная.
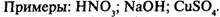
Неэлектролиты — вещества, растворы которых не проводят электрический ток: большинство органических веществ. Связь неполярная или слабополярная.
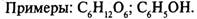
Электролитическая диссоциация
Электролитическая диссоциация — распад электролита на ионы под действием полярных молекул растворителя.
Основы теории электролитической диссоциации – С.Аррениус, 1887г.:
1. Электролиты при растворении в воде диссоциируют.
2. Под действием электрического тока ионы движутся в растворе: положительно заряженные - к катоду, отрицательно заряженные — к аноду.
3. Диссоциация – обратимый процесс
В молекуле воды связь ковалентная полярная, молекула угловая, следовательно, молекула воды — диполь.
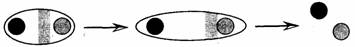
Причина диссоциации веществ с ионной связью: диполи воды разрушают кристаллическую решетку. 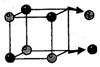
Причина диссоциации веществ с ковалентной полярной связью: молекулы воды вызывают еще большую поляризацию связи вплоть до ее разрыва.
Степень диссоциации. Сильные и слабые электролиты
Степень диссоциации — отношение числа распавшихся молекул к общему числу молекул растворенного вещества:
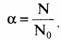
Если а ® 1, то электролит сильный. В растворе практически нет молекул. Примеры: НСl; NaOH; KBr.
Если а ® 0, то электролит слабый. В растворе много молекул и мало ионов. Примеры: H2S; NH3; Fe(SCN)3.
Диссоциация кислот, щелочей и солей
Кислоты
— электролиты, в растворах которых нет других катионов, кроме катионов водорода.
Многоосновные кислоты диссоциируют ступенчато:
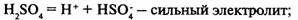
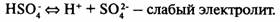
Основания
— электролиты, в растворах которых нет других анионов, кроме гидроксид-ионов.
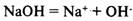
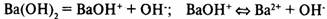
Соли
— электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
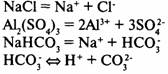
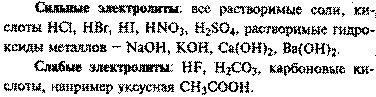
Смотрите также
Расчеты и прогнозирование свойств органических соединений
Задание 24А
на курсовую работу по дисциплине "Расчеты и прогнозирование свойств органических соединений"
1) Для четырех соединений, приведенных в таблице, вычислить , , мето ...
Металлические кластеры
Кластеры уже далеко не новое явление в области химии, но их углубленное изучение открытия нового, всегда представляло интерес для химиков-практикантов. Изучение именно металлических кластер ...







